La classification repose sur deux piliers :
- Le phénotype morpho-fonctionnel (via l’imagerie, surtout CMR)
- La pathobiologie (génétique, histologie, biologie moléculaire)
Trois grandes catégories sont définies :
- Fusion des anciens HCM et RCM dans un continuum phénotypique.
- Dysfonction diastolique majeure ± hypertrophie ventriculaire gauche.
- Mêmes gènes sarcomériques impliqués (ex. : MYH7, MYBPC3, TNNI3).
- Histologie : désorganisation myocytaire, fibrose interstitielle.
- Inclut aussi les formes infiltratives et de surcharge (amylose, Fabry…).
Implication clinique : meilleure reconnaissance des formes mixtes ; intérêt des traitements ciblant la dysfonction diastolique (SGLT2i, inhibiteurs de la myosine…).
- Dilatation et altération systolique du VG hors surcharge ou ischémie.
- Origines génétiques variées (TTN, LMNA, SCN5A, PLN…) ou non génétiques (inflammation, toxiques, nutrition…).
- Fibrose secondaire à la dysfonction, peu étendue, non prédominante.
Implication clinique : focus sur la fonction systolique ; priorité aux traitements anti-HF, moins orientés sur la prévention rythmique (à l’inverse des S/AC).
- Fibrose myocardique non ischémique massive, souvent responsable d’arythmies malignes.
- Gènes impliqués : protéines des desmosomes (PKP2, DSP, DSG2…), mais aussi PLN, FLNC, DES…
- Localisation : ventricule droit (ARVC), gauche (ALVC) ou les deux.
- Fibrose visualisée en LGE CMR avec un pattern « ring-like » ou épicardique.
Implication clinique : nécessité de diagnostiquer précocement la fibrose, souvent avant la défaillance systolique. La prévention de la mort subite (via DAI) devient prioritaire.
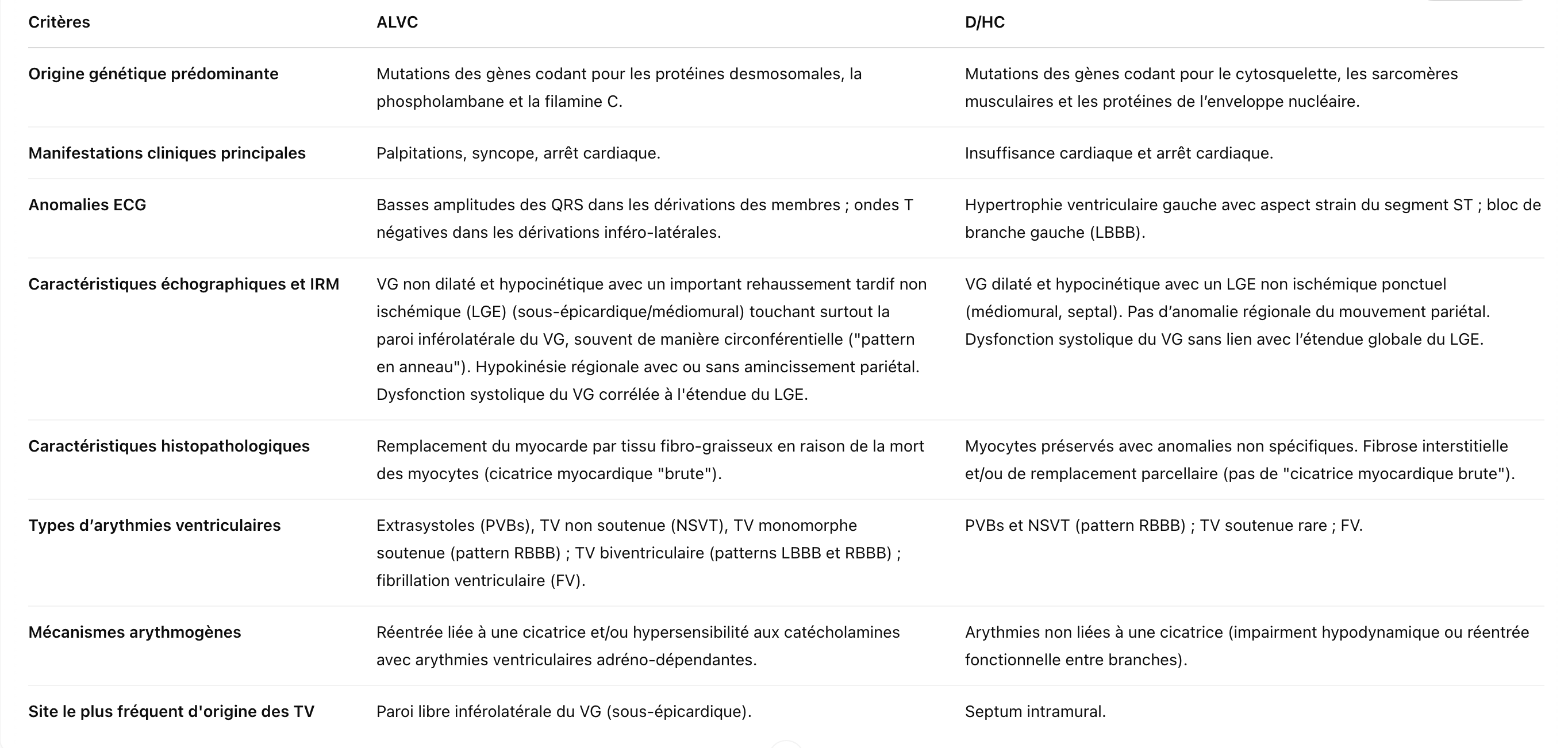
Traduction du tableau original : Diagnostic différentiel entre la cardiomyopathie ventriculaire gauche arythmogène (ALVC) et la cardiomyopathie dilatée/hypocinétique (D/HC) (d’après Corrado et al., 2024)
Elle évite les erreurs diagnostiques entre DCM et formes S/AC gauches (souvent mal identifiées).
Elle oriente la stratégie thérapeutique :
- S/AC = priorité au risque rythmique et au DAI précoce.
- D/HC = priorité à la fonction contractile et au traitement de l’IC.
- H/RC = traitements ciblant la diastole, dépistage des formes infiltratives.
Elle permet d’intégrer des formes “phénocopies” non génétiques (sarcoïdose, myocardites, amylose…) dans un cadre cohérent.
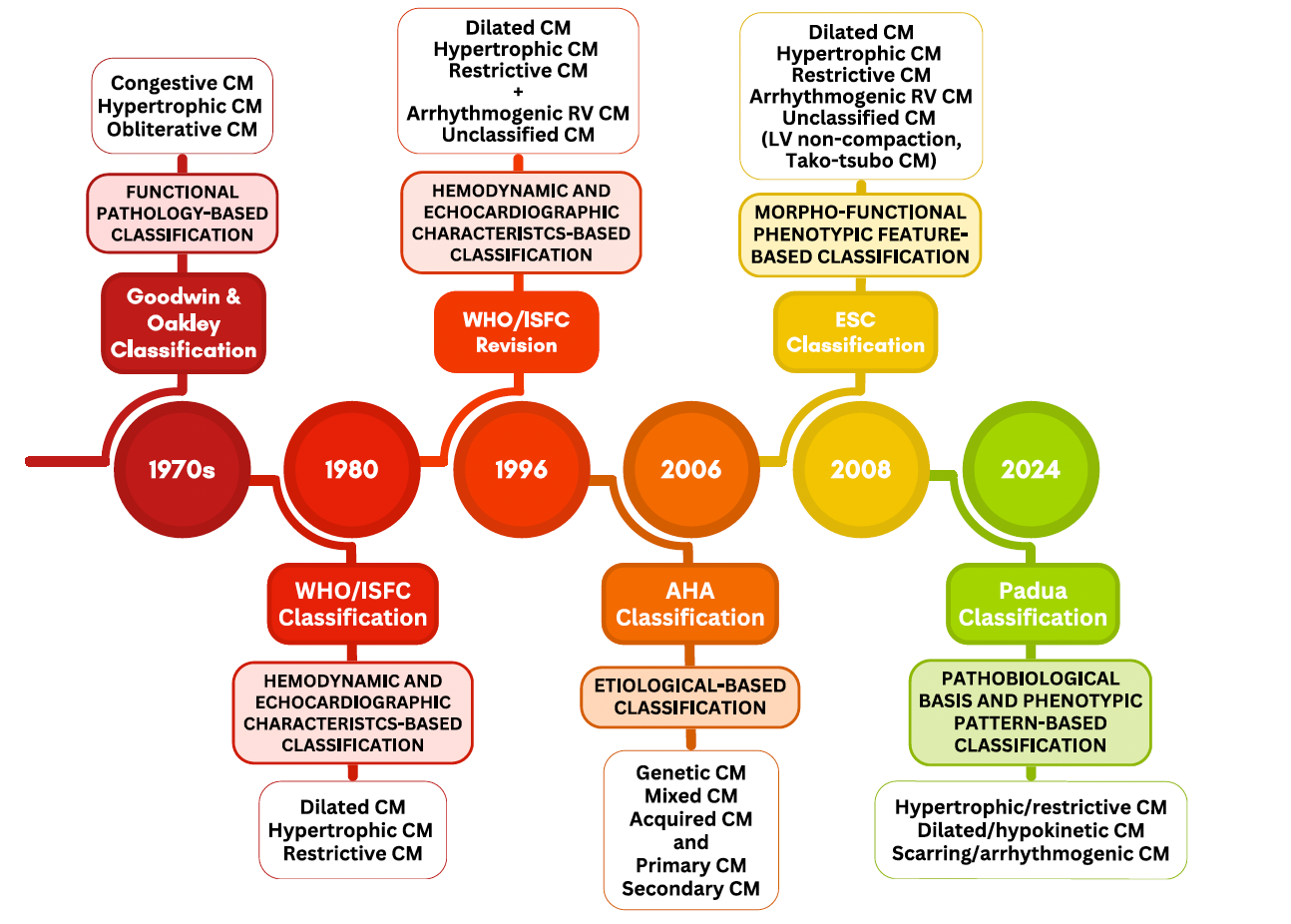
Ce schéma retrace l’évolution des classifications des cardiomyopathies depuis les années 1970 jusqu’à la classification de Padoue en 2024. Initialement fondées sur des critères fonctionnels ou anatomopathologiques (classification de Goodwin & Oakley), les classifications ont progressivement intégré les données hémodynamiques (WHO/ISFC), puis l’étiologie (AHA 2006), et les traits morpho-phénotypiques (ESC 2008). La classification de Padoue (2024) marque une avancée majeure en regroupant les cardiomyopathies selon des profils phénotypiques et biologiques combinés, en trois grandes catégories : hypertrophique/restrictive, dilatée/hypokinétique et cicatricielle/arythmogène, intégrant ainsi les apports de la génétique, de l’imagerie moderne (IRM cardiaque), et des mécanismes physiopathologiques.
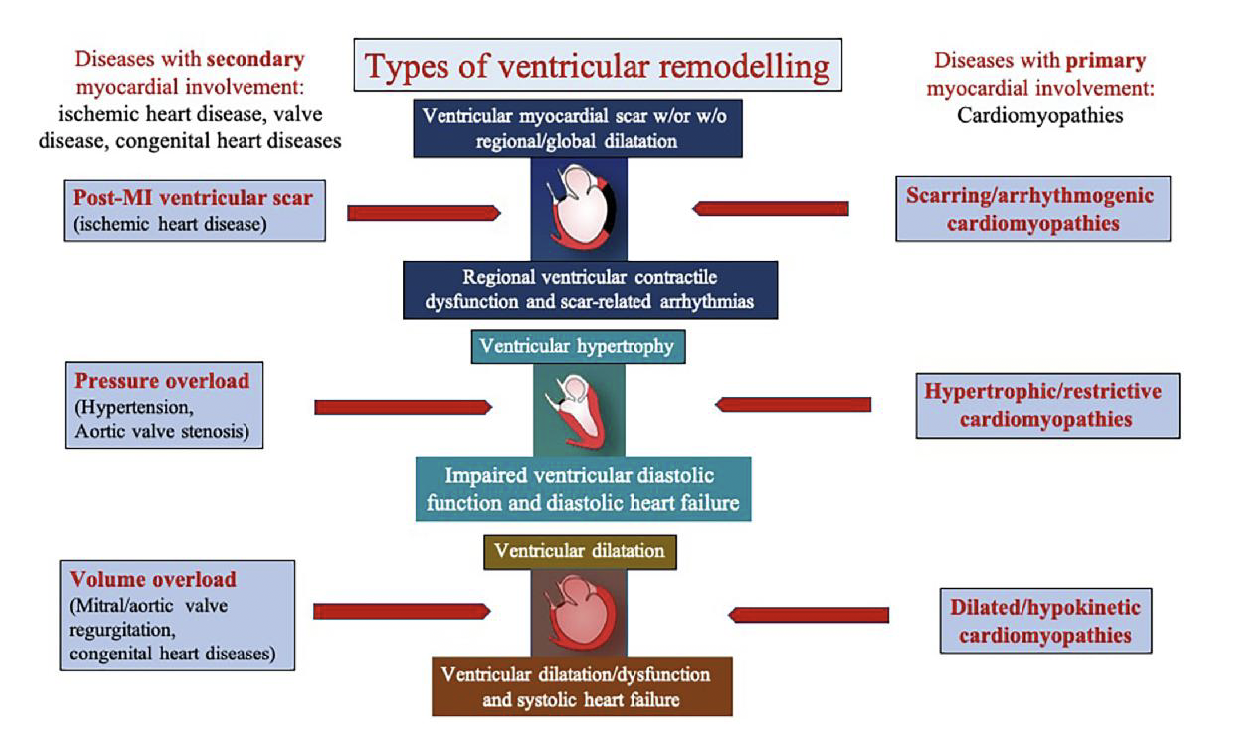
Ce schéma illustre les trois grands types de remodelage ventriculaire associés aux cardiomyopathies dans la classification de Padoue. Il met en parallèle les maladies à atteinte myocardique secondaire (comme les cardiopathies ischémiques, valvulopathies, etc.) et les cardiomyopathies à atteinte primaire. Ainsi, les cardiomyopathies hypertrophiques/restrictives reflètent les remodelages liés à une surcharge de pression (hypertension, sténose valvulaire), les cardiomyopathies dilatées/hypocinétiques ceux induits par une surcharge de volume (régurgitations valvulaires), et les cardiomyopathies cicatricielles/arythmogènes ceux dus à des cicatrices post-infarctus, menant à des arythmies et une dysfonction systolique. Cette classification relie donc phénotypes, mécanismes hémodynamiques et remodelages.
La classification de Padoue marque un tournant : elle ne remplace pas les anciennes approches, mais les synthétise en intégrant les progrès de l’imagerie et de la biologie moléculaire.
Pour les cliniciens, elle permet une lecture plus fine, plus homogène, et surtout plus utile sur le plan thérapeutique.







